الكترونات الذرة عند الرسم والتمثيل تمثل هي العامل الاساسي لها. كل البروتونات والنيوترونات تقع داخل نواة الذرة بالتالي فأن الالكترونات الخاصة بالذرة هي التي تتموضع في المدارات. كل مدار من مدارات الذرة الواحدة يحتوي على مجموعة من الالكترونات وعند تجاوزها يتم تحويلها الى المدار الاخر. لهذا سوف نشرخ لكم تمثيل الضرة بشكل مبسط على امل ان يتم شرحها بشكل متقدم او اكثر تعقيدا.

أين توجد الكترونات الذرة؟
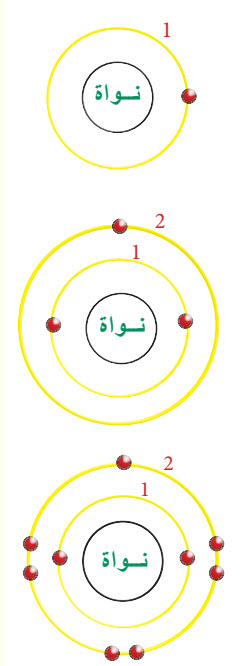
أن أبسط ذرة في الكون هي ذرة الهيدروجين لأنها تحتوي على بروتون واحد في نواتها ، كما يوجد الكترون واحد في مدارها الخارجي يدور حول النواة، ولكون حجم النواة صغير جدا مقارنة بحجم الذرة، لذا يكون اغلب المحيط الخارجي عبارة عن فراغ يدور فيه هذا الالكترون في مدارات محددة .
تبعد هذه المدارات عن النواة بأبعاد مختلفة وحجم هذه المدارات يحدد حجم الذرة. يوجد عدد محدد من المدارات مقدارها سبعة. ترسم المدارات على شكل دوائر حول النواة، ولكل واحد منها رقم محدد، فيعطى للمدار الأول وهو الأقرب إلى النواة الرقم 1، والثاني رقم 2، والثالث رقم 3….. وهكذا.
ان المنطقة التي يدور فيها الالكترون حول النواة يسمى المدار الألكتروني، ويكون لكل مدار عدد محدد منالإلكترونات التي يمكنها الدوران فيه حول النواة.
دوران الإلكترون حول النواة:
- انظر إلى مروحة كهربائية وهي ساكنة.
- هل يمكنك تمييز عدا الأذرع المتصلة بها؟
- اشغل المروحة على أقصى درجة لها.
- هل يمكنك تمييز احد الأذرع للمروحة؟
- ما العلاقة بين سرعة دوران اذرع المروحة ودوران الالكترونات حول نواة الذرة ؟

سؤال: ما المدار الألكتروني؟
كيف يتم التوزيع الالكتروني للذرة؟
هل سألنا أنفسنا عن كيفية توزيع الالكترونات في مدارات الذرة ؟ أن ذلك يتم وفق قواعد معينة ومحددة، إذ يتم ملئ هذه المدارات ابتداءا من المدار الأقرب للنواة، ثم الذي يليه وهكذا، بحيث تكون السعة القصوى لعدد الالكترونات في المدار الأول إلكترونين، والسعة القصوى لعدد الالكترونات للمدار الثاني ثمان الكترونات، والسعة القصوى لعدد الالكترونات للمدار الثالث ثمان الكترونات ، بحيث أن عدد الالكترونات على المدارات تكون مساوية للعدد الذري لتلك الذرة.
فمثلا عنصر الهيدروجين H الذي عدده الذري (1=Z) وعدد الالكترونات =1 عندها يمكن رسم نواة عنصر الهيدروجين يحيط بها مدار واحد کدائرة، ثم نرسم الالكترون وكما موضح الشكل . أما في حالة عنصر الليثيوم Li الذي عدده الذري (3=Z) وعدد الالكترونات فيه =3. يمكنك أن تلاحظ أنه بمجرد اكتمال ملء المدار الأول القريب من النواة بالكترونين ، عندها يبدأ التوزيع الالكتروني على المدار الثاني (2) الأبعد عن النواة وعدد الالكترونات فيه يساوي واحد والذي سعته القصوى (8) الكترونات.
أما بالنسبة لعنصر الفلور F الذي عدده الذري (9=Z) وعدد الإلكترونات = 9. تلاحظ انه بمجرد اكتمال ملء المدار الأول القريب من النواة يبدأ التوزيع الالكتروني على المدار الثاني الأبعد عن النواة الذي عدد الالكترونات فيه يساوي سبعة ورقم المدار هو 2 وسعته القصوى (8) الكترونات. حيث يمكننا مشاهدة توزيع الالكترونات داخل الذرة.
سؤال: ارسم التوزيع الإلكتروني لعنصر الهيليوم He الذي عدده الذري يساوي 2.
أمثلة:
عنصر البورون B : العدد الذري = عدد البروتونات – عدد الالكترونات =5
المدار الأول 2
المدار الثاني 3

عنصر النتروجين N: العدد الذري = عدد الالكترونات = 7 في الذرة
أول مدار 2
ثاني مدار 5

عنصر الفسفور P : العدد الذري = عدد الالكترونات = 15
المدار الأول 2
ثاني مدار 8 في الذرة
الالكترونات في المدار الثالث 5 داخل الذرة
سؤال: رتب المدارات الثلاثة الأولى للذرة في جدول واذكر عدد الألكترونات في كل مدار؟