الذرات والعناصر هي التي تكون العناصر الكيميائية والتي ترمز الى مواد مختلفة. هذه العناصر تكون المركبات الكيميائية. اجتماع كل هذه وتفصيلها في الدراسة ومن ثم جمعها مع بعض سوف يسهل على الطلبة او متلقي العلم لمعرفة ماذا تعني بسهولة. يمكن ان يكون الجانب الكيميائي مسيطر في هذه الصفحة ولكنها ايضا تحتوي على جانب فيزيائي ايضا.

أهمية الذرات والعناصر
ما مدارات الذرة ؟
خطوات العمل:
- أرسم اربع دوائر في الورقة، واكتب حول الدائرة المركزية (النواة) ، واكتب حول الدائرة الأولى القريبة من النواة 1 والثانية 2، والثالثة البعيدة عن النواة 3.
- أستخدم الدبابيس الملونة الخضراء)، اثبت احدى عشر دبوسة في النواة والتي تمثل هذا البروتونات ( الشحنة الموجبة).
- أوزع الدبابيس (الحمراء) والتي تمثل الإلكترونات ( الشحنة السالبة) كالاتي :
- أوزع دبوسين على دائرة 1، وثمان دبابيس على دائرة 2، ودبوس واحد على دائرة 3.
- ما شحنة الذرة؟ أقوم بإزالة الإلكترون الأخير من دائرة 3.
- ماذا أسمي الذرة عند فقدانها الإلكترونات؟
- ماذا أسمي الدوائر الثلاث حول النواة؟

الفكرة الرئيسية
تتكون الذرة من النواة والالكترونات، تتمركز النواة في وسط الذرة، وتحتوي البروتونات والنيوترونات، أما الالكترونات فتدور حولها بمدارات مختلفة. وهنالك تفاوت بین حجم الذرة وحجم النواة. يعبر عن العناصر الكيميائية عن طريق الرموز.
نتاجات التعلم: في نهاية هذا المقال ساکون قادرا على أن :
- أقارن بين حجم الذرة وحجم النواة.
- أحدد العدد الذري والعدد الكتلي للعنصر.
- أفهم عملية توزيع الإلكترونات حول النواة.
- أتعرف إلى رموز بعض العناصر.
ماذا يوجد داخل الذرة ؟
الذرة هي أصغر جزء من المادة في هذا الكون، وهي لا ترى بالعين المجردة ، فكل العناصر الموجودة تتكون من ذرات، وعلى الرغم من صغر الذرة، إلا أنها تتكون من جسيمات أصغر وهي النواة والإلكترونات.
النواة: تشغل النواة الجزء المركزي من الذرة وتتركز بها معظم كتلتها ، وشحنتها موجبة حيث تحتوي نوعين من الجسيمات هي البروتونات والنيوترونات.
البروتون (p): جسيم يحمل شحنة موجبة وهو المسؤول عن تحديد نوع العنصر الذي تنتمي إليه الذرة. لا تخلو الذرات ولا العناصر من البروتونات.
النيوترون(n): جسيم متعادل الشحنة وله تقريبا نفس كتلة البروتون. يتم وصف كل النيوترونات على انها مكونات الذرة الاساسية ولكنها دائما متعادلة من حيث الشحنة.
الإلكترون (e): جسيم سالب الشحنة كتلته ضئيلة جدا، أصغر من كتلة البروتون أو النيوترون بحوالي 1840 مرة تقريبا يدور حول النواة في مدارات مختلفة.
المدار الالكتروني: المنطقة التي يدور فيها الإلكترون. كل الذرات التي تكون العناصر او المركبات لها مدارات الكترونية متعددة ولكل ذرة على حدة وتتصل مع بعضها باواصر.
مركز الذرة التي تمثلها النواة صغير جدا، اذ حجم النواة أصغر من 100000 مرة من حجم الذرة، وبذلك نستطيع أن نقدر الحجم النسبي للذرة ونواتها وكما لو أن الذرة بحجم ملعب الشعب الدولي، فإن النواة ستمثل حجم كرة قدم في مركزها .
المفردات:
- العدد الذري Atomic Number (Z)
- العدد الكتلي Mass Number(A)
- رمز العنصر Element symbol
- المدار الالكتروني Orbital
- الحجم الذري Atomic Volume
سؤال: ما اسم الجسيمات الموجودة داخل النواة؟
ما الصفة المميزة للعنصر؟
يسمى عدد البروتونات الموجودة داخل نواة العنصر بالعدد الذري والذي يرمز له (Z). وبما أن عدد البروتونات داخل النواة يساوي عدد الالكترونات خارج النواة في الذرة المتعادلة الشحنة لذلك يمكن التعبير عنه:
العدد الذري (Z)= عدد البروتونات في النواة – عدد الإلكترونات حول النواة
فالعدد الذري هو ذلك العدد الذي يميز ذرة عنصر عن ذرة عنصر آخر، إذ لا يوجد عنصران متشابهان في العدد الذري مطلقا، فالعدد الذري هو هوية العنصر التي تميزه عن باقي العناصر. فالعناصر في الطبيعة لها أعداد ذرية مختلفة تبدأ من العدد 1 و هو العدد الذري لذرة الهيدروجين، ا أعلى عدد ذري يخص عنصرا طبيعيا فهو 92 و هو العدد الذري الخاص بذرة اليورانيوم. كل هذا يمكن ايجاده في العناصر والذرات المختلفة في الامثلة ادناه.
ما العدد الكتلي للعنصر (A) ؟
لكون كتلة الذرة تتمركز في نواتها فان العدد الكتلي هو مجموع عدد البروتونات والنيوترونات الموجودة داخل نواة الذرة، أي أن: العدد الكتلي (A) = عدد البروتونات (Z) + عدد النيوترونات (N)
مثال : ذرة العدد الكتلي لها يساوي 27 وعددها الذري يساوي 13، ما عدد الإلكترونات والبروتونات والنيوترونات فيها؟
الحل :
العدد الذري هو عدد البروتونات في النواة، أي أن : العدد الذري (Z)= عدد البروتونات في النواة وبما أن عدد البروتونات = عدد الالكترونات = 13 : عدد الإلكترونات= 13
عدد البروتونات (Z) + عدد النيوترونات (N) = العدد الكتلي (A)
عدد البروتونات (Z) – العدد الكتلي (A) = عدد النيوترونات (N)
27-13 = 14
سؤال: ذرة عنصر الأوكسجين O يحتوي 8 بروتونات و 8 نيوترونات اكتب العدد الذري والعدد الكتلي للذرة؟
كيف نكتب رمز العنصر ؟
العناصر في الطبيعة عددها كثير، ولتسهيل التعامل مع هذه العناصر، وضع علماء الكيمياء رمز العنصر وهي طريقة تستعمل لتمثيل العناصر في الطبيعة. فاذا كان رمز العنصر مثلا يتألف من حرف واحد فيكتب على شكل (حرف كبير)، أما إذا كان رمز العنصر متكونة من حرفين فالأول يكتب على شكل ( حرف كبير)، والثاني يكتب على شكل (حرف صغير)، ولا يوجد عنصران لهما نفس الرمز الكيميائي.
رموز بعض العناصر:
- هيدروجين H
- أوكسجين 0
- نتروجين N
- کاربون C
- كلور Cl
- فلور F
- هيليوم He
- صوديوم Na
- فسفور P
- مغنيسيوم Mg
- كالسيوم Ca
- بوتاسيوم K
- الألمنيوم Al
- سيليكون Si
- نيون Ne
- كبريت S
- فضة Ag
- حديد Fe
- نحاس Cu
- بروم Br
- ذهب Au
- رصاص Pb
- زئبق Hg
- پود I
- بريليوم Be
- ليثيوم Li
- بورون B
وتمثل هذه الرموز ذرة واحدة من العنصر، فمثلا رمز الكاربون C يمثل ذرة كاربون واحدة، أما اذا عبر عنه بشكل 4C فهذا يعني اربع ذرات من الكاربون، بالنسبة للعناصر الأخرى، مثل Ca فهو رمز عنصر الكالسيوم، وهو ايضا يمثل ذرة واحدة من الكالسيوم، اما اذا كتب 10Ca فانه يمثل عشر ذرات من الكالسيوم .
سؤال: ماهو رمز العنصر؟ وما اهميته؟
كيف أعبر عن العدد الذري والعدد الكتلي للعنصر ؟
ان الطريقة المتفق عليها في التعبير عن ذلك هو كتابة العدد الذري أسفل رمز العنصر من ناحية اليسار، ويكتب العدد الكتلي أعلى رمز العنصر من ناحية اليسار للعنصر، فمثلا للعنصر (X) يكتب كالآتي: X اسفله العدد الذري Z واعلاه العدد الكتلي A.
فيما يلي صورة تبين الاعداد الذرية والكتلية لبعض العناصر الكيميائية :
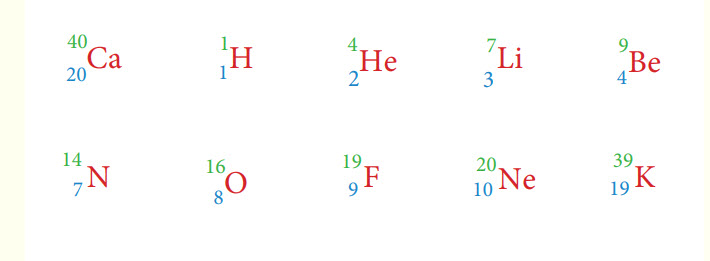
حيث نلاحظ ان العدد الذري للاوكسجين هو 8 بينما العدد الكتلي 16. كذلك يمكن تمثيل العدد الذري للكالسيوم على انه 20 بينما العدد الكتلي هو 40 . دائما العدد الكتلي يكون رقمه اكثر من العدد الذري بمقدار الضعف او الضعف زائدا 1 كما يتضح في الامثلة اعلاه.
سؤال: كيف يمكننا تمثيل العدد الذري والعدد الكتلي لعنصر الصوديوم الذي عدده الذري 11 وعدد كتلته 23؟